Vision för ett energiomställning av energianvändning globalt
För att kunna realisera ett systemskifte från dagens situation med stora utsläppsmängder av CO2 , NOx och andra utsläpp i atmosfären vid energiproduktion, transporter och industriella processer måste en total omställning göras med att använda Hydrogen , H2.
Detta genom att producera hydrogen, H2, i elektrolysörer med att nyttja alla till buds tillgängliga elkraftsanläggningar med noll CO2–utsläpp som står till buds idag och kommande utbyggnader med ett restutnyttjande av all tillgänglig produktionskapacitet av eleffekt mellan skillnaden av installerad och uttagen momentan elproduktion avsett årstid .
På de sättet kan en hydrogenkapacitet byggas upp över tid för att bryta från dagens energiförbrukningar som sker med fossila källor till att ske med klimatneutrala produktionssätt. Generering av elkraft med bränsleceller kan därmed spridas över hela Sverige – eller världen för den delen – med grön hydrogen, H2 .
Bränsleceller, det finns ett antal typer av dessa, där vi för dagen prioriterar ”PEM” Bränsleceller, ”Polymer/proton Electrolyte Membrane” som har kommit längst i sin kommersiella utveckling vilket innebär att omvandla hydrogen, H2, till elektricitet med restprodukterna värme och vattenånga som utsläpp.
För att försörja bränsleceller med primärbränslet hydrogen, H2, kan detta ske med olika sorter av vätgas. Dessa klassificeras med olika färger från svart, grå, blå, grön osv. beroende på hur vätgasen produceras.
I detta sammanhang är det den gröna vätgasen, H2, som är den mest intressanta energibäraren sett över tid. Grön vätgas produceras genom att i en elektrolysör spjälka rent vatten, H2O, till vätgas, H2, och syrgas, O2, genom att tillföra elektrisk energi från vindkraftverk alternativt solpaneler eller för den delen vatten- och kärnkraft. Den totala verkningsgraden för denna process är ca 70 % med restprodukten värme på ca 30 %.
Finessen med denna metod är att vid varje tidpunkt, då vindkraft eller solpaneler eller andra elkraftproducerande anläggningar inte nyttjas fullt ut i förhållande till installerad effekt – nyttja den mellanliggande eleffekten som då uppstår genom att vid varje givet tillfälle producera hydrogen , H2, i elektrolysörer.
Elektrolysörer
En storfördel kan ligga i att elektrolysörer placeras så att den kan nyttja el från ett icke koncessionspliktigt nät. Detta innebär att elen kan nyttjas direkt från exempelvis en
solcellsanläggning, en vindkraftspark eller annan elkraftproducerande anläggning utan att påverkas av avgifter som tillkommer om elen tas från det allmänna nätet.
Detta sker enligt processen: 2𝐻2𝑂 + 2 𝑒− → 𝐻2 + 2𝑂𝐻−
Kompression
För att komprimera ett kilogram vätgas med atmosfärstryck till 200 bars tryck, behövs cirka 10-15 MJ/m3. För att ytterligare komprimera gasen, från atmosfärstryck till 700 bar, är motsvarande energiåtgång ca 17-20 MJ/m3
Lagring
Lagring av vätgas kan antingen ske i gasform i låga tryck, gasform i höga tryck, flytande form, hydridformat, eller lagring i fasta material. I dagsläget tillämpas vanligen lagring som högt trycksatt gas, eller vätskeform. Högtryckståliga kompositmaterial eller stål utgör oftast inneslutningen för lagringskärlet för gaser rent allmänt och så även för vätgas.
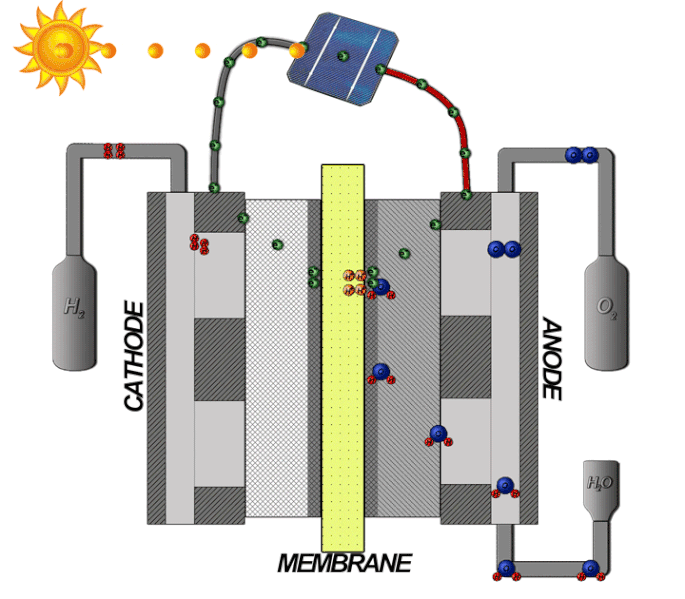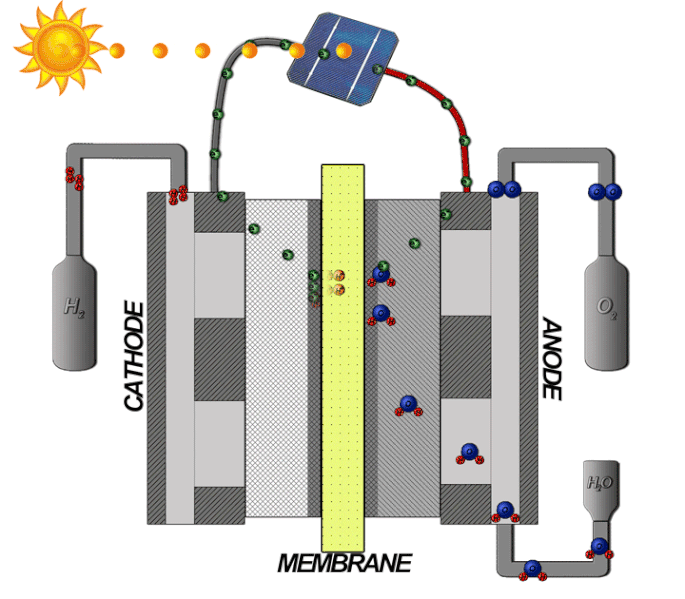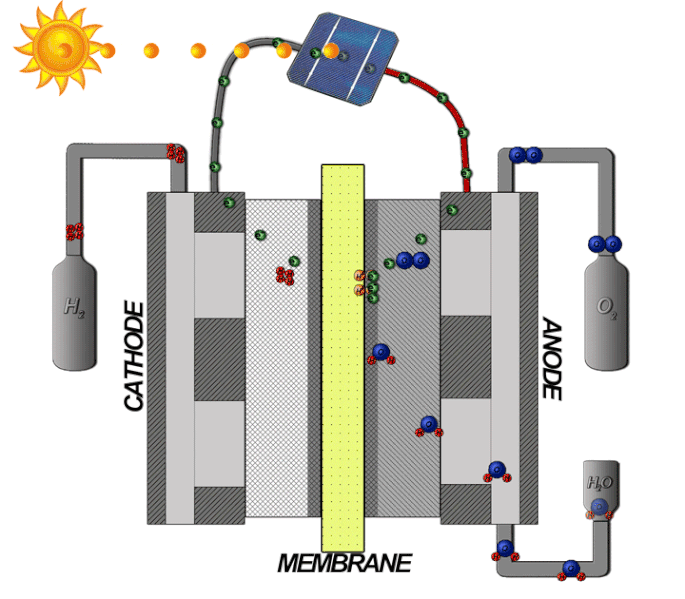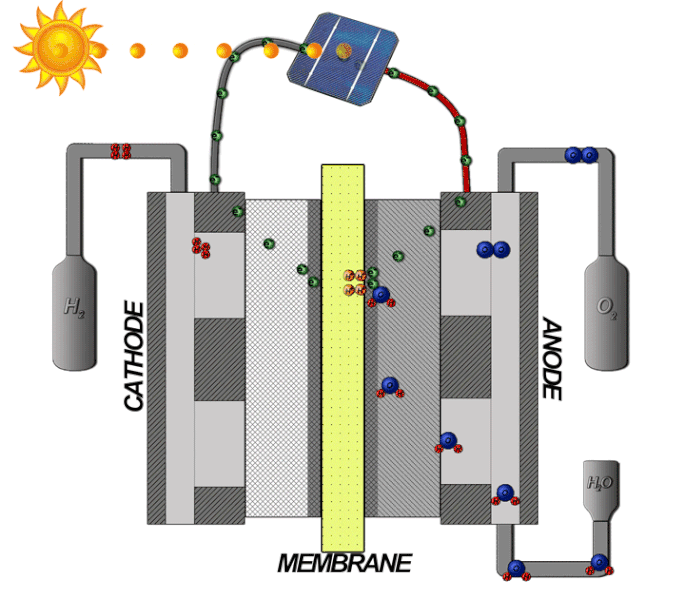
Bränsleceller-teori
Bränslecellstekniken innebär att omvandla kemisk energi till elektrisk energi. I en bränslecell med ett membran som tillåter protoner att passera mellan en katod och anod, där själva reaktionen sker. På samma sätt som en PEM-elektrolysör är elektrolyten tillverkad av en polymer som bara släpper igenom de positivt laddade vätejonerna, alltså protoner. Vätgasen matas in med högt tryck på bränslecellens anodsida, där den delas upp i protoner och elektroner med hjälp av en katalysator, enligt följande formel: 2𝐻2 → 4𝐻+ + 4𝑒−
Protonerna passerar genom membranet, medan elektronerna först leds vidare och kan med sin elektriska energi driva en extern krets som elektriska motorer eller andra elektriska applikationer. När elektronerna sedan leds till katodsidan, slås de samman igen med protonerna. Syrgas från luften passerar på katodsidan genom katalysatorn, och delar upp molekylen till två negativt laddade syreatomer. Denna negativa laddning drar till sig den positiva laddning som vätejonerna har och de bildar då tillsammans enligt följande formel: 𝑂2 + 4𝐻+ + 4𝑒− → 2𝐻2𝑂 .
Den totala reaktionen beskrivs med följande formel: 2𝐻2 + 𝑂2 → 2𝐻2𝑂 se illustrationen nedan:

